- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
Nitrous acid là gì? Công dụng của Nitrous acid trong đời sống
21/06/2023
Mặc định
Lớn hơn
Nitrous acid (Axit nitơ ) là hợp chất không bền và có tính axit yếu. Nó chỉ tồn tại trong dung dịch muối nitrat.. Axit nitrous được phát hiện bởi Scheele. Nó thu được bằng cách chưng cất chì nitrat khô hoàn toàn trong một nồi chưng cất, được gắn với một máy thu. Một chất lỏng đi qua là axit nitơ.
- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
Tìm hiểu chung
Nitrous acid là gì?
Nitrous acid (công thức phân tử HNO2), một hợp chất không bền, có tính axit yếu, chỉ được điều chế ở dạng dung dịch loãng, nguội. Nó rất hữu ích trong hóa học trong việc chuyển đổi các amin thành các hợp chất diazonium, được sử dụng trong sản xuất thuốc nhuộm azo. Nó thường được điều chế bằng cách axit hóa dung dịch của một trong các muối của nó, các muối nitrit, bền hơn.
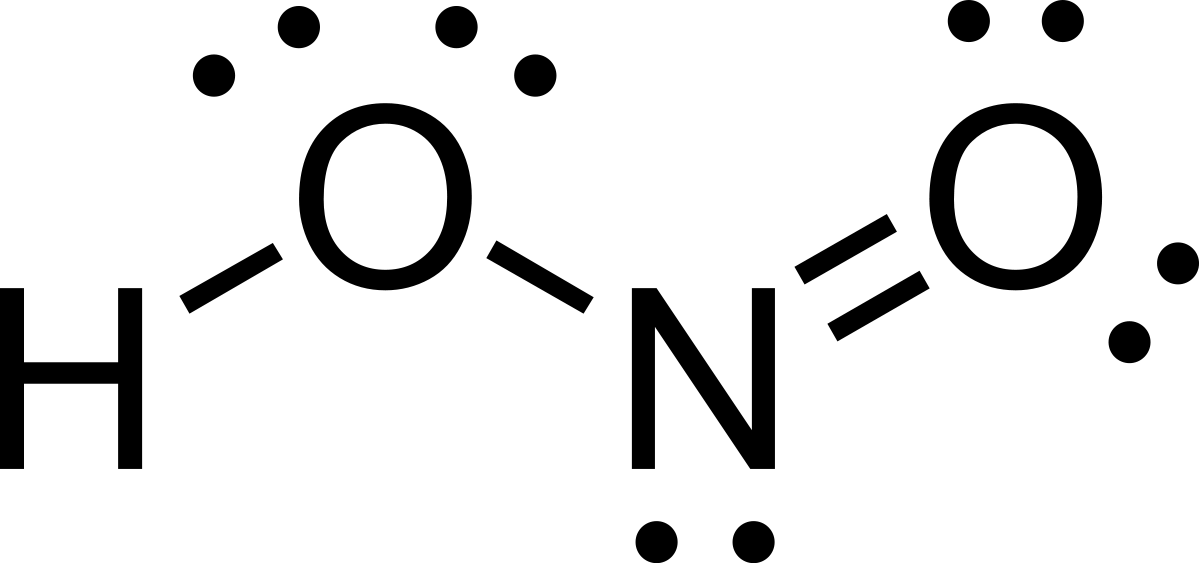
Nitrous acid có công thức phân tử HNO2
Nitrous acid phân hủy thành oxit nitric, NO và axit nitric, HNO3. Nó có thể phản ứng như một chất oxy hóa hoặc chất khử; nghĩa là, nguyên tử nitơ của nó có thể được hoặc mất electron trong phản ứng với các chất khác. Axit nitơ, ví dụ, oxy hóa ion iotua thành iot nguyên tố nhưng khử brom thành ion bromua.
Nitrous acid là một axit yếu và đơn chức chỉ được biết trong dung dịch, ở pha khí và ở dạng nitrit (NO−2) muối. Axit nitơ được sử dụng để tạo ra muối diazonium từ các amin. Các muối diazonium tạo thành là thuốc thử trong phản ứng ghép nối azo để tạo ra thuốc nhuộm azo.
Tính chất hóa học của axit nitơ - HNO2
Nó có tính axit mạnh, cực kỳ dễ bay hơi và bốc khói dày đặc; sôi ở nhiệt độ thấp 82oC và khối lượng riêng là 1,45.
Ở trạng thái hơi, axit nitơ không thay đổi do tác dụng của nhiệt, nhưng khi trộn với nước sẽ xảy ra hiện tượng sủi bọt cùng với sự phát triển của khí nitơ.
Axit nitơ ở trạng thái bốc khói là hoàn toàn không mong muốn nhưng hỗ trợ quá trình đốt cháy phốt pho hoặc than củi, khi chúng được đưa vào nó ở trạng thái cháy.
Sự phân hủy
Nitrous acid dạng khí, hiếm khi gặp, phân hủy thành nitơ đioxit, oxit nitric và nước:
2 HNO2 → NO2 + NO + H2O
Trong các dung dịch ấm hoặc đậm đặc, phản ứng tổng thể tạo ra axit nitric, nước và oxit nitric:
3 HNO2 → HNO3 + 2 NO + H2O
Nitrous acid sau đó có thể bị oxy hóa lại trong không khí thành axit nitric, tạo ra phản ứng tổng thể:
2 HNO2 + O2 → 2 HNO3
Quá trình oxy hóa khử
Với ion I− và Fe2 +, NO được tạo thành:
2 HNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
2 HNO2 + 2 FeSO4 + 2 H2SO4 → Fe2 (SO4) 3 + 2 NO + 2 H2O + K2SO4
Với ion Sn2 +, N2O được tạo thành:
2 HNO2 + 6 HCl + 2 SnCl2 → 2 SnCl4 + N2O + 3 H2O + 2 KCl
Với khí SO2, NH2OH được tạo thành:
2 HNO2 + 6 H2O + 4 SO2 → 3 H2SO4 + K2SO4 + 2 NH2OH
Với Zn trong dung dịch kiềm, NH3 được tạo thành:
5 H2O + KNO2 + 3 Zn → NH3 + KOH + 3 Zn (OH) 2
Quá trình oxy hóa bằng Nitrous acid có sự kiểm soát động học so với sự kiểm soát nhiệt động lực học, điều này được minh họa rõ nhất rằng axit nitơ loãng có thể oxy hóa I− thành I2, nhưng axit nitric loãng thì không thể.
Điều chế sản xuất Nitrous acid
Nitrous acid thường được tạo ra bằng cách axit hóa dung dịch nước của natri nitrit với một axit khoáng. Quá trình axit hóa thường được tiến hành ở nhiệt độ nước đá, và HNO2 được tiêu thụ tại chỗ. Axit nitơ tự do không ổn định và bị phân hủy nhanh chóng.
Nitrous acid (HNO2): Một axit yếu chỉ tồn tại trong dung dịch. Nó có thể tạo thành nitrit hòa tan trong nước và các este ổn định.
Nitrous acid cũng có thể được sản xuất bằng cách hòa tan dinitơ trioxit trong nước theo phương trình: N2O3 + H2O → 2 HNO2
Cơ chế hoạt động Nitrous acid
Nitrous acid là chất có tính chất oxy hóa khử, là chất phân hủy tạo ra được các sản phẩm ứng dụng được trong đời sống.
Công dụng
Nitrous acid được sử dụng như một phần của hỗn hợp tiêm tĩnh mạch với natri thiosulfat để điều trị ngộ độc xyanua được đánh giá là đe dọa đến tính mạng. Nó nằm trong Danh sách Thuốc Thiết yếu của Tổ chức Y tế Thế giới, một danh sách các loại thuốc quan trọng nhất cần thiết trong hệ thống y tế cơ bản. Ngoài ra còn có nghiên cứu để điều tra khả năng ứng dụng của nó đối với các phương pháp điều trị đau tim, chứng phình động mạch não, tăng áp phổi ở trẻ sơ sinh và nhiễm trùng Pseudomonas aeruginosa.

Nitrous acid được sử dụng để điều trị ngộ độc xyanua
Liều dùng & cách dùng
Tuân theo chỉ định liều lượng và cách dùng từ dược sĩ hay bác sĩ, đọc kỹ thông tin trong tờ hướng dẫn sử dụng trước khi điều trị với Nitrous Acid.
Ứng dụng
Nitrous acid được sử dụng cho rất nhiều ứng dụng trong hóa học hữu cơ để tạo ra rất nhiều hóa chất. Bây giờ, chúng ta sẽ tìm hiểu, những công dụng của axit nitơ là gì.
Điều chế muối diazonium
Trong công nghiệp, axit nitrơ có rất nhiều ứng dụng. Một ứng dụng quan trọng của hợp chất này là được sử dụng trong việc điều chế muối diazonium, sau đó phản ứng tạo màu azo với các amin thơm và phenol.

Nitrous acid điều chế muối diazonium
Giảm khả năng cháy nổ
Được sử dụng để loại bỏ bản chất độc hại trong hợp chất natri azit có khả năng gây nổ.
Thành phần trong nhiên liệu lỏng
Nitrous acid cũng được sử dụng làm chất ôxy hóa trong tên lửa nhiên liệu lỏng.
Để điều chế rượu
Nitrous acid phản ứng với amin béo bậc một để tạo ra rượu bậc một. Nhưng hãy nhớ rằng, đối với phản ứng này, NaNO2 và HCl đặc được sử dụng để điều chế axit HNO2.
Để điều chế N-Nitrosamine
N-nitrosamine là một loại dầu màu vàng. Khi một hợp chất amin bậc hai được xử lý với axit nitơ, N-Nitrosamine được tạo ra dưới dạng sản phẩm.
Điều chế Benzenediazonium clorua
Benzenediazonium clorua được sử dụng để làm chất màu. Khi xử lý anilin bằng NaNO2 và HCl loãng dưới 50C, sản phẩm là Benzenediazoni clorua.
Lưu ý
Phải thận trọng khi sử dụng điều trị với Nitrous Acid. Luôn tuân theo lời khuyên từ dược sĩ hay bác sĩ, đọc kỹ thông tin trong tờ hướng dẫn sử dụng.
-
https://pubchem.ncbi.nlm.nih.gov/compound/Nitrous-acid#section=3D-Conformer
-
https://www.britannica.com/science/nitrous-acid
-
https://byjus.com/chemistry/nitrous-acid/
/https://cms-prod.s3-sgn09.fptcloud.com/header_responsive_1702f839d2.png)
/https://cms-prod.s3-sgn09.fptcloud.com/header_desktop_f832104627.png)
