- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
Oxalic Acid là gì? Vai trò và ứng dụng trong đời sống
08/12/2025
Mặc định
Lớn hơn
Oxalic Acid là một acid hữu cơ tự nhiên, tồn tại trong nhiều loại rau xanh và thực phẩm như rau bina, củ cải và cacao. Hợp chất này thường được sử dụng trong công nghiệp để tẩy rửa, tẩy gỉ sắt và trong sản xuất hóa chất khác. Oxalic Acid có khả năng liên kết với ion canxi, vì vậy tiêu thụ quá nhiều có thể gây hình thành sỏi thận. Đây là hợp chất có tính ăn mòn và độc hại nếu hít hoặc nuốt phải với nồng độ cao, cần bảo quản và sử dụng cẩn thận.
- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
- Tìm hiểu chung
- Liều dùng & cách dùng
- Ứng dụng
- Lưu ý
Tìm hiểu chung
Oxalic Acid là gì?
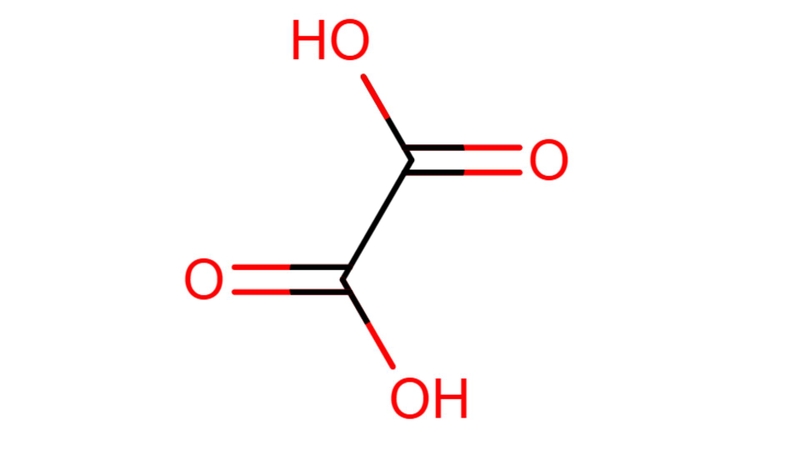
Oxalic Acid còn gọi là acid etandioic, là một acid hữu cơ dicarboxylic với công thức hóa học H₂C₂O₄. Ở dạng tinh thể, nó không màu, dễ tan trong nước và có vị chua. Đây là một acid hữu cơ, thường xuất hiện tự nhiên trong nhiều loại rau củ quả và ngũ cốc như rau chân vịt, cải bó xôi, măng, súp lơ xanh, khoai tây, cà tím… và tồn tại dưới dạng muối oxalat. Trong công nghiệp, Oxalic Acid có thể được tổng hợp từ natri formate, carbohydrate hoặc mùn cưa, và được sử dụng trong tẩy rửa, tẩy gỉ và sản xuất hóa chất.
Oxalic Acid có khả năng liên kết với ion canxi, tiêu thụ quá nhiều có thể dẫn đến sỏi thận, đồng thời có tính ăn mòn, nên cần sử dụng cẩn trọng.
Điều chế sản xuất Oxalic Acid
Oxalic Acid có thể được sản xuất công nghiệp qua nhiều phương pháp hóa học và sinh học khác nhau:
Oxy hóa natri formate với kiềm
Trong phương pháp phổ biến này, natri formate được đun nóng trong môi trường kiềm (thường là natri hydroxide) và oxy hóa bằng oxy không khí. Quá trình tạo ra natri oxalat, sau đó được acid hóa để thu Oxalic Acid tinh khiết. Phương pháp này hiệu quả cao, dễ kiểm soát và phù hợp cho sản xuất công nghiệp, đặc biệt khi cần sản phẩm tinh khiết dạng muối oxalat.
Oxy hóa carbohydrate bằng acid nitric
Carbohydrate như glucose, sucrose hoặc tinh bột được oxy hóa bởi acid nitric mạnh. Các nhóm hydroxyl trong phân tử carbohydrate bị chuyển hóa thành nhóm carboxyl, tạo ra Oxalic Acid. Phương pháp này thường được sử dụng khi nguồn nguyên liệu carbohydrate sẵn có, giúp thu Oxalic Acid tinh khiết, nhưng cần kiểm soát cẩn thận do acid nitric mạnh và phản ứng có thể tạo sản phẩm phụ.

Đun nóng mùn cưa hoặc lignocellulose với kiềm ăn da
Mùn cưa hoặc các vật liệu lignocellulose được xử lý với natri hydroxide ở nhiệt độ cao. Lignin và cellulose bị phân hủy và oxy hóa, tạo ra muối oxalat trong dung dịch. Sau đó, dung dịch được acid hóa để thu Oxalic Acid tự do. Đây là phương pháp tận dụng nguồn nguyên liệu sinh khối, thân thiện với môi trường và phù hợp với cơ sở sản xuất quy mô vừa.
Lên men dung dịch đường với nấm mốc
Một số loại nấm mốc như Aspergillus niger có khả năng chuyển hóa đường thành Oxalic Acid thông qua quá trình sinh học. Dung dịch đường được lên men trong điều kiện kiểm soát nhiệt độ, pH và thông khí, sau đó Oxalic Acid được thu hồi. Phương pháp sinh học ít tốn năng lượng, phù hợp để sản xuất Oxalic Acid “xanh” cho ứng dụng thực phẩm hoặc dược phẩm, mặc dù hiệu suất thường thấp hơn phương pháp hóa học.
Cơ chế hoạt động
Oxalic Acid (H₂C₂O₄) hoạt động chủ yếu dựa trên tính acid mạnh và khả năng tạo phức với ion kim loại. Với hai nhóm carboxyl (-COOH), Oxalic Acid có thể liên kết với các ion kim loại như Ca²⁺, Fe³⁺, Mg²⁺ để tạo thành muối oxalat không tan hoặc ít tan. Trong cơ thể, quá trình này dẫn đến hình thành sỏi thận (CaC₂O₄), còn trong công nghiệp, phản ứng tương tự được ứng dụng để tẩy gỉ sắt hoặc loại bỏ ion kim loại khỏi dung dịch.
Ngoài ra, nhóm -COOH có khả năng nhường proton (H⁺), khiến Oxalic Acid có tính acid mạnh hơn nhiều so với acid đơn chức như acid acetic. Tính chất này giải thích vị chua khi hòa tan trong nước và khả năng tham gia vào các phản ứng acid - bazơ hoặc xúc tác hóa học, đóng vai trò quan trọng trong cả môi trường sinh học lẫn ứng dụng công nghiệp.
Công dụng
Oxalic Acid được sử dụng rộng rãi như một chất tẩy gỉ và tẩy cáu cặn nhờ khả năng phản ứng mạnh với các ion kim loại. Khi tiếp xúc với bề mặt kim loại, đá, gỗ hoặc gạch bị ố vàng hay gỉ sét, nó tạo phức với ion sắt và canxi, giúp làm sạch bề mặt hiệu quả. Đặc tính này còn cho phép Oxalic Acid làm mềm nước cứng bằng cách loại bỏ các ion Ca²⁺ và Mg²⁺ trong dung dịch. Trong các phản ứng hóa học, Oxalic Acid đóng vai trò điều chỉnh pH, có thể nhường proton (H⁺) để tham gia phản ứng acid - bazơ, hoặc được dùng như chất xúc tác, chất khử hay chất oxy hóa tùy điều kiện phản ứng.
Trong phòng thí nghiệm và các nghiên cứu hóa học, Oxalic Acid là công cụ quan trọng để chuẩn độ ion kim loại, loại bỏ tạp chất gây nhiễu trong phân tích định lượng, hoặc tạo phức màu phục vụ đo quang phổ. Nó còn là nguyên liệu để tổng hợp các muối oxalat - chất trung gian quan trọng để sản xuất dược phẩm, hóa chất và vật liệu kỹ thuật. Một số hợp chất oxalat còn được nghiên cứu như tác nhân ổn định, chất chống kết tinh hoặc phụ gia phản ứng trong hóa học hữu cơ. Oxalic Acid cũng được sử dụng để xử lý sợi vải, cải thiện độ bám màu, làm sạch bề mặt gỗ, hoặc hỗ trợ bảo quản mẫu vật trong nghiên cứu sinh học.
Ở quy mô sinh học, muối oxalat có khả năng ức chế một số vi sinh vật bằng cách cạnh tranh dinh dưỡng hoặc làm thay đổi pH môi trường. Trong nghiên cứu sinh học và các quy trình lên men, muối oxalat đôi khi được sử dụng để khảo sát ảnh hưởng của ion kim loại hoặc điều chỉnh pH môi trường. Tuy nhiên, Oxalic Acid không phải là chất kháng khuẩn hay kháng nấm chính thức và việc sử dụng cần được kiểm soát chặt chẽ do nguy cơ tạo sỏi thận khi liên kết với canxi.

Liều dùng & cách dùng
Oxalic Acid được sử dụng phổ biến dưới dạng dung dịch hoặc bột, tùy theo mục đích. Trong công nghiệp và vệ sinh, dung dịch Oxalic Acid được pha loãng theo nồng độ thích hợp để tẩy gỉ, tẩy cáu cặn trên kim loại, gỗ, đá hoặc gạch. Khi sử dụng, bề mặt cần được làm ướt, sau đó thoa dung dịch và để phản ứng trong thời gian ngắn trước khi rửa sạch với nước. Cần tuân thủ nồng độ và thời gian xử lý để tránh ăn mòn bề mặt.
Trong phòng thí nghiệm, Oxalic Acid thường được dùng để chuẩn độ ion kim loại hoặc tạo phức màu trong phân tích quang phổ. Lượng sử dụng được tính toán chính xác dựa trên phản ứng hóa học, và dung dịch thường được chuẩn bị với nồng độ tiêu chuẩn. Ngoài ra, nó có thể được sử dụng làm chất khử hoặc chất oxy hóa trong các thí nghiệm hóa học, tùy theo điều kiện phản ứng.
Trong các ứng dụng sinh học hoặc nghiên cứu lên men, Oxalic Acid được sử dụng với nồng độ thấp để điều chỉnh pH hoặc kiểm soát sự phát triển của vi sinh vật. Việc sử dụng phải cẩn trọng, đảm bảo không gây ảnh hưởng đến sinh trưởng của tế bào hoặc gây rối loạn cân bằng khoáng chất. Trong bất kỳ ứng dụng nào, người dùng nên tuân thủ các biện pháp an toàn như mang găng tay, kính bảo hộ và làm việc trong môi trường thông thoáng để tránh tiếp xúc trực tiếp hoặc hít phải.
Ứng dụng
Ngành gia dụng
Nhờ khả năng tạo phức với ion kim loại, Oxalic Acid trở thành một thành phần quan trọng trong các sản phẩm làm sạch. Khác với các acid mạnh có thể ăn mòn bề mặt, Oxalic Acid nhắm đến các oxit sắt (gỉ sét) và vết bẩn hữu cơ một cách chọn lọc, đồng thời bảo vệ vật liệu.
- Tẩy gỉ sét: Khi sử dụng dưới dạng dung dịch hoặc bột nhão (5 - 10%), Oxalic Acid thẩm thấu vào bề mặt xốp như bê tông, gỗ hoặc kim loại, chuyển đổi gỉ sét không tan thành sắt oxalat hòa tan. Nhờ đó, các bề mặt kim loại, dụng cụ hay sân vườn có thể được làm sạch và phục hồi dễ dàng.
- Phục hồi gỗ: Dung dịch Oxalic Acid pha loãng (3 - 5%) có tác dụng tẩy các vết bẩn do nước, mực in hoặc tannin trên gỗ sồi mà không làm thay đổi cấu trúc gỗ. Đây là phương pháp được các chuyên gia sử dụng để làm sạch và chuẩn bị đồ nội thất cổ trước khi hoàn thiện lại.
- Làm mới gạch và vữa: Kết hợp với chất hoạt động bề mặt, Oxalic Acid giúp hòa tan các cặn khoáng, cặn xà phòng và vết bẩn trên gạch, bồn tắm hay thép không gỉ mà không gây mài mòn. Nhiều sản phẩm thương mại tận dụng đặc tính này để đánh bóng bề mặt mà vẫn giữ an toàn cho vật liệu.

Ngành dệt nhuộm
Trong sản xuất dệt may, Oxalic Acid đóng vai trò kép, vừa là chất cầm màu vừa điều chỉnh độ pH, giúp thuốc nhuộm bám chắc vào sợi vải. Ứng dụng của nó bao gồm:
- Chuẩn bị sợi: Xử lý bông hoặc vải lanh bằng Oxalic Acid trước khi nhuộm giúp loại bỏ dư lượng kiềm còn sót lại từ quá trình kiềm hóa, tạo ra môi trường pH trung tính lý tưởng cho thuốc nhuộm.
- Cố định màu nhuộm: Đối với các loại sợi protein như len và lụa, Oxalic Acid liên kết với các phân tử thuốc nhuộm (ví dụ thuốc nhuộm gốc anthraquinone), tạo thành các phức hợp ít tan, giúp màu bền lâu. Điều này đặc biệt quan trọng với các màu đen sâu và xanh navy trên vải denim.
- Kiểm soát tạp chất kim loại: Oxalic Acid trung hòa các ion kim loại trong nước như sắt và canxi, vốn có thể gây phản ứng với thuốc nhuộm, tránh hiện tượng màu không đều.
Chế biến gỗ và phục hồi đồ nội thất
Thợ mộc sử dụng Oxalic Acid để tẩy vết bẩn trên gỗ hoặc loại bỏ các vết nước sẫm màu. Acid này giúp làm sáng gỗ sồi, gỗ thông bị đổi màu, tạo lớp bề mặt đồng đều trước khi sơn vecni. Có thể coi Oxalic Acid như “cục tẩy” cho vết mực hay hư hại do thời tiết trên gỗ.
Ứng dụng dược phẩm và phòng thí nghiệm
Trong phòng thí nghiệm, nó được sử dụng để tinh chế hóa chất, phân tích khoáng chất hoặc chuẩn độ ion kim loại.
Đánh bóng và xử lý bề mặt kim loại
Khả năng hòa tan oxit kim loại một cách nhẹ nhàng nhưng hiệu quả khiến Oxalic Acid trở thành thành phần quan trọng trong các ngành công nghiệp như hàng không vũ trụ, ô tô và trang sức:
- Thụ động hóa nhôm: Các bộ phận máy bay được xử lý bằng dung dịch Oxalic Acid (2 - 5%) để loại bỏ oxy hóa bề mặt và tạo lớp oxalate bảo vệ, ngăn ăn mòn mà không cần sử dụng cromat độc hại.
- Phục hồi đồ bạc: Khi phản ứng với vết xỉn màu (bạc sunfua), Oxalic Acid giúp phục hồi độ sáng bóng cho bạc cổ mà không cần chà xát mạnh. Thợ kim hoàn sử dụng dung dịch nhúng có pH kiểm soát để làm sạch các chi tiết tinh xảo.
- Xử lý thép trước khi sơn: Trong sản xuất ô tô, dung dịch gốc Oxalic Acid loại bỏ vảy thép và cải thiện độ bám dính của lớp sơn, chuẩn bị bề mặt thép cho quá trình phủ lớp bảo vệ.

Lưu ý
Các lưu ý khi sử dụng Oxalic Acid:
- Bảo vệ cá nhân: Khi sử dụng Oxalic Acid, luôn mang găng tay, kính bảo hộ và khẩu trang để tránh tiếp xúc trực tiếp với da, mắt và hít phải bụi hoặc hơi. Dung dịch acid có thể gây kích ứng da, bỏng nhẹ hoặc viêm mắt.
- Pha chế dung dịch: Pha Oxalic Acid với nước theo nồng độ khuyến cáo cho từng ứng dụng. Luôn thêm acid vào nước, không làm ngược lại, để tránh phản ứng nhiệt mạnh gây bắn dung dịch.
- Thông gió: Khi sử dụng trong phòng thí nghiệm hoặc không gian kín, đảm bảo thông gió tốt để tránh hít phải hơi acid, đặc biệt với nồng độ cao.
- Bảo quản: Oxalic Acid nên được để trong bình kín, tránh ẩm, nhiệt độ cao và ánh sáng trực tiếp, giữ xa tầm tay trẻ em và vật nuôi.
- Nguy cơ sức khỏe: Do Oxalic Acid có khả năng tạo phức với canxi, tiêu thụ hoặc tiếp xúc lâu dài với nồng độ cao có thể gây sỏi thận hoặc thiếu hụt khoáng chất. Không dùng trực tiếp cho thực phẩm mà không kiểm soát nồng độ.
- Xử lý và thải bỏ: Dung dịch dư thừa phải được loại bỏ theo quy trình an toàn, trung hòa trước khi xả ra môi trường, tránh tác động đến nước, đất hoặc sinh vật.
- Sử dụng đúng mục đích: Chỉ sử dụng Oxalic Acid cho các ứng dụng phù hợp như tẩy rỉ, làm sạch, xử lý gỗ, chuẩn độ trong phòng thí nghiệm, hoặc các ứng dụng sinh học đã được kiểm soát nồng độ.
- A comprehensive review of recent advances in the applications and biosynthesis of oxalic acid from bio-derived substrates: https://www.sciencedirect.com/science/article/abs/pii/S0013935124006078?
- Oxalic acid synthesis: https://www.chemicalbook.com/synthesis/oxalic-acid.htm?
- PRODUCTION OF OXALIC ACID BY ASPERGILLUS NIGER:
- https://jurnal.tekmira.esdm.go.id/index.php/imj/article/view/567?
- The Six Major Uses of Oxalic Acid: A Versatile Chemical Companion: https://www.tjcyindustrialchem.com/recommend-products/the-six-major-uses-of-oxalic-acid.html?
- oxalic acid: https://www.britannica.com/science/oxalic-acid
:format(webp)/Left_item_Desktop_30a228ca37.png)
:format(webp)/Right_item_Desktop_62b912099a.png)
:format(webp)/Background_Responsive_af5478c004.png)
:format(webp)/Background_Desktop_aee1f2e29a.png)
:format(webp)/smalls/Left_item_Responsive_1ce0e03501.png)

:format(webp)/smalls/Right_item_Responsive_0b39a7d534.png)